Il y a 6 millions d’années, après la séparation de notre lignée de celle des chimpanzés, la duplication d’un gène a favorisé l’expansion du néocortex, siège de nos fonctions cognitives supérieures. Et d’autres ont suivi. Une passionnante enquête !
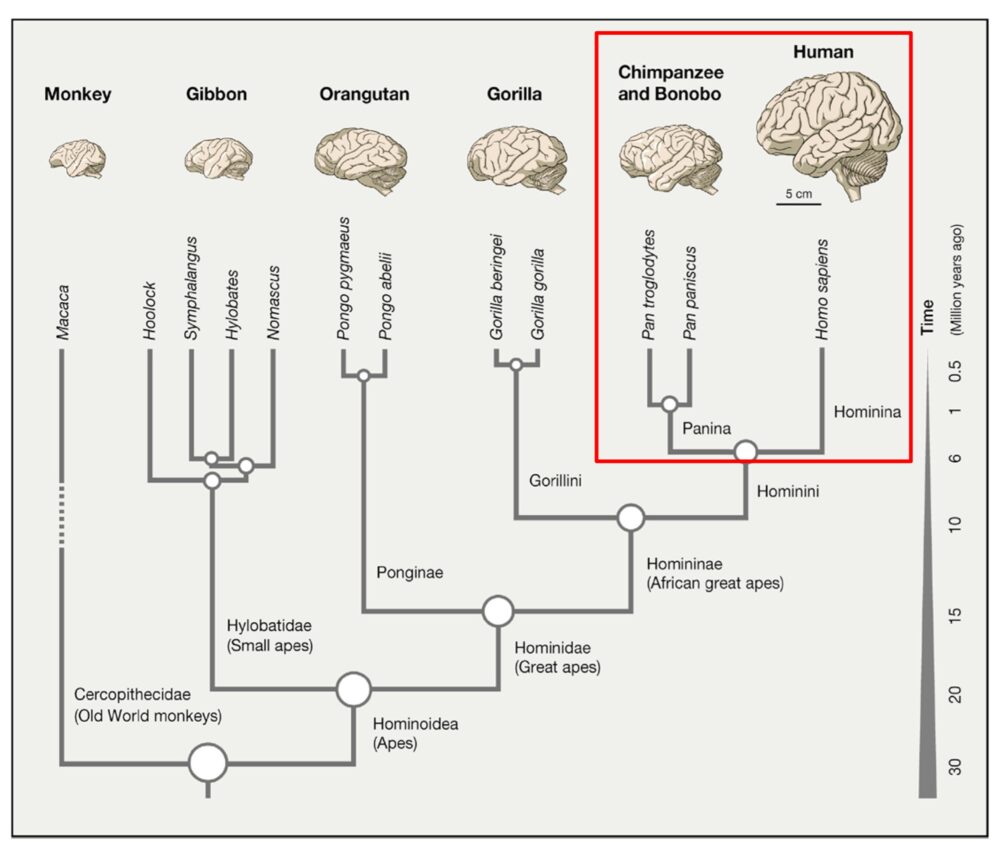
Si nous, les êtres humains, sommes dotés de capacités cognitives supérieures, nous le devons au néocortex, cette couche de matière grise qui recouvre nos deux hémisphères cérébraux. Si tous les mammifères ont un néocortex, celui de l’homme est un peu plus épais (quelques couches de cellules) et surtout nettement plus étendu : dix fois plus que celui du macaque et mille fois plus que celui de la souris. Pour tenir dans notre modeste boîte crânienne, il est donc obligé de se plisser, formant des sillons et des circonvolutions caractéristiques. Cette conformation du cerveau est-elle pour autant la signature du cerveau humain ? Ce n’est pas si simple. D’autres mammifères, comme les dauphins ou les éléphants, ont un cortex plus entendu et plus gyrifié avec des circonvolutions cérébrales, ou gyrus. avec des circonvolutions cérébrales, ou gyrus. que celui l’homme. En réalité, ce qui constitue la signature de notre cerveau, c’est plutôt la densité et le nombre de neurones qui composent les couches les plus superficielles du néocortex. Organisés en réseaux, ces neurones sont essentiels à la capture, au traitement et à la transmission de l’information cérébrale, ainsi qu’à la communication entre les différentes régions du cortex. Bref, ce sont eux qui rendent possibles nos fonctions cognitives supérieures,
A quels gènes cette particularité du néocortex humain est-elle due ? A quel moment, dans l’évolution, sont-ils apparus ? Telles sont les questions que se sont posées des chercheurs de l’institut MaxPlank, en Allemagne. Et les réponses qu’ils ont trouvées apportent de nouveaux éléments sur nos origines.
En introduisant le gène ARGHAP11B dans des embryons de souris, les chercheurs ont observé une augmentation de la taille du cortex cérébral
Les neurones des couches superficielles de notre cortex sont produits dans l’embryon par des populations de cellules appelées « progéniteurs basaux », en raison de leur localisation dans la partie la plus basale du cerveau par rapport aux ventricules1,2. Plus répandus chez l’humain et les primates non-humains, ces progéniteurs et leur progénie neuronale Les cellules progénitrices se différencient au cours du temps et donnent des neurones. Chaque cellule différenciée (neurone) est considérée comme une progénie neuronale, car issue d'un progéniteur. Les cellules progénitrices se différencient au cours du temps et donnent des neurones. Chaque cellule différenciée (neurone) est considérée comme une progénie neuronale, car issue d'un progéniteur. sont à l’origine des caractéristiques de notre cerveau. C’est précisément à ces cellules que les chercheurs se sont intéressés.
Les avancées dans le domaine de la génétique ont permis aux scientifiques d’avoir accès au profil génétique des cellules, d’identifier les gènes actifs et les protéines produites à différents stades de développement. C’est comme cela qu’on a pu définir des groupes de gènes caractéristiques de chaque espèce et définir leur rôle dans l’évolution. C’est le cas des gènes responsables du développement du cerveau humain. Parmi eux, le gène ARGHAP11B. En l’introduisant dans des embryons de souris, les chercheurs ont observé une augmentation de la taille du cortex cérébral, augmentation due à la prolifération des cellules progénitrices3. Depuis, l’expérience a été répliquée chez le furet et, plus récemment, chez le marmouset, un petit singe d’Amérique du Sud4,5, un modèle primate apprécié pour sa proximité avec l’homme. Chez ce dernier aussi, on a constaté une augmentation des couches superficielles du cortex, permettant ainsi de démontrer le rôle d’ARGHAP11B dans l’expansion du cortex au cours de l’évolution.
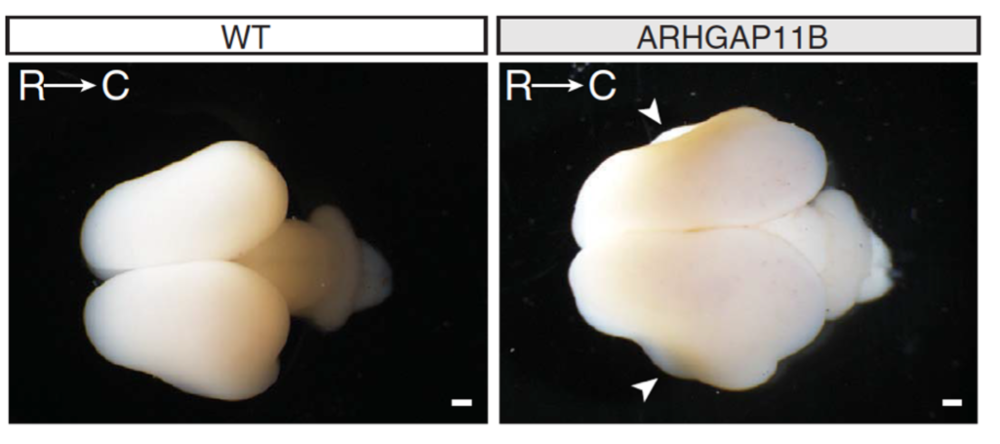
A quel moment, dans l’évolution, ce gène est-il apparu ? Selon les résultats d’analyses phylogéniques, Analyses qui cherchent les liens de parenté entre les organismes vivants Analyses qui cherchent les liens de parenté entre les organismes vivants on retrouve ARGHAP11B dans le génome de l’homme de Néandertal et de l’homme de Denisova mais pas dans celui du chimpanzé3. On peut donc en conclure qu’il est apparu après la séparation de la lignée humaine et de la lignée chimpanzé, il y a 6 millions d’années, mais avant la séparation entre Néandertal et l’homme moderne. En fait, ARGHAP11B est issu d’une duplication partielle du gène ancestral ARGHAP11A qui a entraîné des modifications dans sa structure, à l’origine de ces nouvelles fonctions.
On sait aujourd’hui que ce gène joue un rôle important dans le métabolisme des cellules progénitrices humaines et plus particulièrement des cellules progénitrices basales qui génèrent les neurones superficiels du neocortex.
Mais ARGHAP11B n’est pas le seul gène à être impliqué dans le développement du cortex humain. On peut citer aussi SRGAP2, gène qui a subi plusieurs duplications au cours de son évolution6. La première date de 3,4 millions d’années. Elle a généré le gène SRGAP2B, qui a subi lui-même une duplication pour donner le SRGAP2C.
Présent uniquement dans les neurones humains, le gène SRGAP2C contrôle la morphologie et la densité des branchements de neurones au cours de la maturation. Ce rôle est considéré comme essentiel pour le bon fonctionnement des réseaux de neurones et donc les interactions entre les différentes régions du cerveau.
ARGHAP11B et SRGAP2C sont deux exemples qui illustrent l’importance du phénomène de duplication de gènes dans l’évolution qui a abouti au développement du cerveau humain. Il semble bien qu’un pic de duplication des gènes s’est produit au moment de la séparation de la lignée humaine des autres primates non-humain.
References
1. Smart, I. H. M. Unique Morphological Features of the Proliferative Zones and Postmitotic Compartments of the Neural Epithelium Giving Rise to Striate and Extrastriate Cortex in the Monkey. Cerebral Cortex 12, 37–53 (2002).
2. Betizeau, M. et al. Precursor Diversity and Complexity of Lineage Relationships in the Outer Subventricular Zone of the Primate. Neuron 80, 442–457 (2013).
3. Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science 347, 1465 (2015).
4. Kalebic, N. et al. Human-specific ARHGAP11B induces hallmarks of neocortical expansion in developing ferret neocortex. eLife 7, e41241 (2018).
5. Heide, M. et al. Human-specific ARHGAP11B increases size and folding of primate neocortex in the fetal marmoset. Science 369, 546–550 (2020).
6. Charrier, C. et al. Inhibition of SRGAP2 Function by Its Human-Specific Paralogs Induces Neoteny during Spine Maturation. Cell 149, 923–935 (2012).
7. Xing, L. et al. Serotonin Receptor 2A Activation Promotes Evolutionarily Relevant Basal Progenitor Proliferation in the Developing Neocortex. Neuron 108, 1113-1129.e6 (2020).







