Spécialiste des cellules souches, Pierre Savatier a coordonné l’équipe de chercheurs français qui a créé le premier embryon homme-singe. Alors que le projet de loi sur la bioéthique vient de préciser les conditions de recours aux chimères, il nous éclaire sur les enjeux, les limites et les promesses de cette technologie.
Le 29 juin dernier, la révision de la loi sur la bioéthique a été définitivement adoptée après deux années d’intenses débats. Les discussions ont essentiellement porté sur l’extension de l’assistance médicale à la procréation (PMA) aux couples de femmes et aux femmes célibataires et sur les questions sur la filiation qui en découlent. Mais le texte comporte également des dispositions destinées à encadrer les recherches sur l’embryon humain, les cellules souches embryonnaires et les cellules souches pluripotentes induites, dites « iPS ». Un article de la nouvelle loi a fait couler beaucoup d’encre : il s’agit de l’article 17, qui concerne ce qu’on appelle les « chimères homme-animal ». Certains opposants parlent à son sujet de « transgression majeure », de « brouillage des frontières » entre l’espèce humaine et les espèces animales. Nous avons demandé à Pierre Savatier, directeur de recherche à l’Inserm et spécialiste reconnu des cellules souches (lire son portrait), de nous éclairer sur les enjeux de ce sujet délicat, notamment dans le domaine de la recherche sur le cerveau. Il revient aussi sur l’étude qu’il a coordonnée portant sur la création d’embryons chimères homme-singe.
Qu’est-ce qu’une chimère en science ?
Il s’agit d’une entité biologique formée à partir de cellules issues de deux organismes différents. Cette technologie n’a rien de nouveau. Les premiers embryons chimères datent de 1969 : il s’agissait des embryons caille-poulet, créés par la biologiste française Nicole Le Douarin. Quant aux chimères homme-animal, obtenues en injectant des cellules humaines dans un embryon animal, on les utilise depuis des années dans la recherche biomédicale. On introduit ainsi des cellules humaines tumorales chez des souris afin d’étudier leur multiplication et l’efficacité de molécules thérapeutiques. Mais il a fallu attendre 2013 pour qu’on injecte des cellules souches humaines dans des embryons de souris et 2017 pour le faire dans des embryons de porc.
En France, la recherche sur l’embryon humain n’est possible que sur des embryons dits « surnuméraires ».
Pourquoi utiliser des cellules souches pour créer des chimères ?
Mon équipe travaille depuis plusieurs années sur les cellules souches pluripotentes, une catégorie particulière de cellules souches que l’on trouve dans les embryons de toutes les espèces à un stade très précoce de leur développement. On les appelle pluripotentes car elles peuvent se spécialiser en n’importe quel type cellulaire. Elles peuvent être obtenues soit à partir de l’embryon humain (cellules ES) soit par reprogrammation à partir de cellules adultes (cellules iPS). Les deux modèles cellulaires sont presque identiques mais ils ne présentent pas la même disponibilité. En France, la recherche sur l’embryon humain n’est possible que sur des embryons dits « surnuméraires », obtenus par fécondation in vitro dans le cadre d’un projet parental et cédés par les couples une fois ce projet terminé. L’accès à ces embryons est donc limité. En outre, ces embryons sont souvent congelés à des stades tardifs du développement, ce qui limite le champ d’expérimentation ; et ils ne sont pas toujours de bonne qualité. C’est pour pallier ces difficultés que la recherche se tourne vers les chimères homme-animal, qui permettront de suivre le développement de cellules ES ou iPS humaines dans un embryon hôte animal.
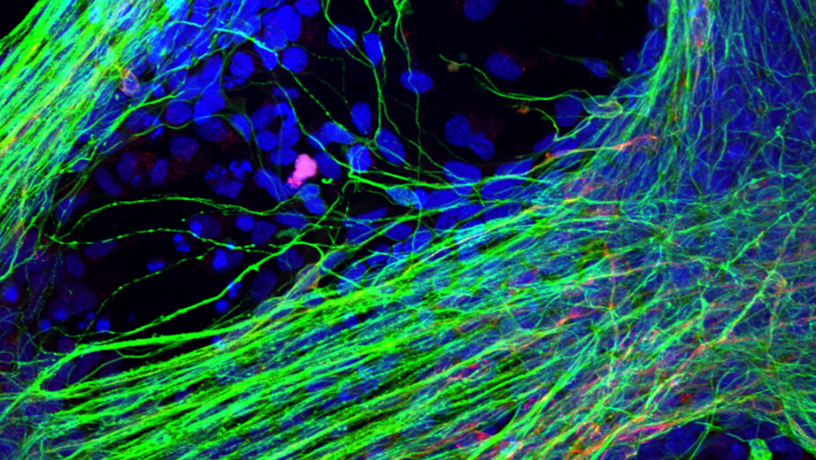
Génération de neurones à partir des cellules souches pluripotentes induites. © Inserm/Afsaneh Gaillard
Cellules souches embryonnaires (ES) : ce sont des cellules isolées à partir de l’embryon humain. Ces cellules sont dites pluripotentes car sont capables de donner tous les types cellulaires d’un organisme.
> En savoir plus sur les cellules ES.
Cellules souches pluripotentes induites (iPS) : ce sont des cellules souches issues de la reprogrammation des cellules somatiques (cellules de la peau, par exemple). Les cellules IPS ont les mêmes caractéristiques que les cellules ES.
> En savoir plus sur les cellules iPS.
Quels objectifs de recherche poursuivez-vous avec les chimères ?
Il s’agit d’abord de mieux comprendre les mécanismes précoces du développement de l’embryon humain. Rappelons que 99% de ce que nous savons sur l’embryogénèse chez les mammifères vient de la souris ! Nous avons donc besoin de nouveaux modèles. Ce qui nous intéresse en particulier, c’est la période qui va du huitième au vingt-huitième jour après la fécondation. Avant le huitième jour, nous disposons des embryons cultivés in vitro ; après le vingt-huitième jour, nous avons accès à de jeunes fœtus provenant d’avortements spontanés ou thérapeutiques ; entre les deux, c’est une sorte de « boite noire ». Or il se passe beaucoup de choses pendant ces trois semaines : les cellules commencent à se différencier, les axes de l’embryon se mettent en place, les ébauches d’organes, dont le système nerveux, apparaissent… Si nous voulons en savoir plus sans utiliser l’embryon humain, on est obligé d’avoir un modèle expérimental : la chimère homme-animal le fournit. Toujours dans le domaine fondamental, on peut aussi utiliser des cellules iPS porteuses d’une mutation correspondant à une maladie génétique humaine et étudier comment elles se développent dans l’embryon chimère.
Un autre objectif de recherche est de parvenir à identifier les gènes qui permettent aux cellules souches de se différencier en tel ou tel type de tissu : neural, cardiaque, intestinal, etc. C’est une étape essentielle au progrès de la thérapie cellulaire régénératrice, qui consiste à greffer des cellules souches chargées de restaurer la fonction d’un tissu ou d’un organe. On peut aussi utiliser les chimères pour valider a priori la sécurité des technologies émergentes utilisées en thérapie cellulaire pour soigner des pathologies cardiaques, la dégénérescence maculaire liée à l’âge (DMLA) ou la maladie de Parkinson.
La fabrication d’organes en vue de la transplantation relève encore de la science-fiction !
Une troisième application consiste à tester l’effet de molécules thérapeutiques. Plutôt que de le faire sur des organoïdes dans des boîtes de culture, on le fait sur de véritables organismes vivants constitués de cellules humaines.
Enfin, la dernière application est la fabrication d’organes en vue de la transplantation. L’opération consisterait à injecter des cellules humaines d’un patient chez un animal qu’on aurait au préalable modifié génétiquement pour l’empêcher de produire tel ou tel organe. Les cellules humaines seraient, quant à elles, programmées pour fabriquer l’organe désiré. Mais cela relève encore de la science-fiction !
Votre équipe a récemment créé les premiers embryons chimères homme-singe. Quel est l’intérêt scientifique de ces travaux ?
Nous sommes partis d’un constat : quand on injecte des cellules iPS humaines dans un embryon animal, cela marche très mal. Elles ont du mal à coloniser l’embryon animal, ce qui entraine un taux de chimérisme très faible. Nous voulions savoir si cela était dû à la distance interespèce ou à la qualité intrinsèque des cellules iPS humaines. Pour cela, nous avons injecté des cellules iPS humaines dans des embryons de lapin et des embryons de singes macaques. Le résultat est sans appel : cela marche très mal dans les deux cas. Conclusion : les cellules iPS humaines n’ont pas cette capacité à coloniser un organisme étranger, contrairement aux cellules ES ou iPS de souris, par exemple, qui colonisent très bien les embryons d’autres espèces – lapin, porc ou macaque. Reste à découvrir d’où vient cette capacité extraordinaire des cellules souches de souris. Est-elle une exception ? Peut-on la transmettre aux cellules iPS humaines ?
Pourquoi selon vous était-il important de modifier l’article de la loi portant sur les chimères ?
La précédente loi de bioéthique, datant de 2011, était ambiguë : elle interdisait la création d’embryons transgéniques ou chimériques sans plus de précision. Faisait-elle référence à l’adjonction de cellules humaines dans un embryon animal ou à l’opération inverse ? Ce flou a placé les chercheurs dans une certaine insécurité juridique jusqu’à ce que le Conseil d’État, en 2018, estime que cette interdiction ne s’appliquait pas à la recherche réalisée sur l’embryon animal. L’article 17 de la nouvelle loi lève cette ambiguïté : l’interdiction ne concerne que l’adjonction de cellules animales à un embryon humain.
Comprenez-vous les craintes qui se sont exprimées à propos de la création de chimères ?
Je les comprends tout à fait, évidemment. La seule chose que je regrette, c’est que les personnes qui s’opposent à ces technologies utilisent la plupart du temps de mauvais arguments… Il est important de dissiper un malentendu : notre objectif n’est pas de fabriquer des organismes hybrides, mi-homme-mi-animal, mais de mieux comprendre le développement de l’embryon à ses débuts sans utiliser d’embryons humains. Cela dit, il est vrai que le terme « chimère » fait peur car il est chargé symboliquement et propice à tous les fantasmes.
La science est par nature transgressive. Faire de la science, c’est aller au-delà de la ligne d’horizon.
Que répondez-vous à ceux qui parlent de « transgression » ?
Je leur réponds que la science est par nature transgressive. Faire de la science, c’est aller au-delà de la ligne d’horizon. Depuis la Renaissance, la science transgresse des limites : dissections, transfusions sanguines et, plus près de nous, greffes du cœur (rappelons-nous qu’il a fallu changer la loi pour que l’opération soit légale), fécondation in vitro, etc. Quant à ceux qui s’inquiètent du « franchissement de la barrière d’espèce », je leur fais remarquer qu’on le fait depuis longtemps – chaque fois que l’on ajoute chez l’animal des gènes qui ne sont pas présents naturellement – et qu’on ne s’en émouvait pas jusqu’ici… Si l’on veut comprendre le développement du système nerveux central humain, il faut d’une manière ou l’autre le manipuler. Et comme on ne va pas le faire chez l’homme, il faut utiliser des modèles.
Quelles sont les lignes rouges que vous vous êtes fixées ?
Nous nous interdisons d’abord de laisser se développer et naître un animal qui aurait des caractères humains. Cela n’aurait d’ailleurs aucun intérêt scientifique. Ensuite, nous nous engageons à ne pas faire du chimérisme dans le cerveau. C’est-à-dire que nous veillons à ce qu’il n’y ait pas de contribution importante des cellules humaines à la construction du cerveau animal, en particulier du cortex cérébral. Enfin, nous refusons de produire des gamètes humains dans les organes génitaux d’un animal. L’agence de biomédecine sera particulièrement vigilante sur ces trois points dans les travaux de recherche qui seront menés à l’avenir.
Ce que change la nouvelle loi de bioéthique
- Travaux sur les cellules ES et cellules iPS humaines : passent sous le régime de simple déclaration.
- Travaux sur les embryons humains : restent sous le régime de l’autorisation par l’Agence de biomédecine. Embryons conçus in vitro dans le cadre d’une assistance médicale à la procréation qui ne font plus l’objet d’un projet parental. Durée maximale de mise en culture : 14 jours.
- Culture d’embryons transgéniques : autorisée pour permettre l’utilisation d’outils d’édition du génome (CRISPR-Cas9) à des fins de thérapie génique. Le transfert de ces embryons dans un utérus à des fins de gestation reste strictement interdit.
Êtes-vous satisfait du nouveau cadre réglementaire ?
Oui. Cette loi est excellente : elle permet à la recherche de se développer tout en fixant des limites claires. On peut s’attendre prochainement à un flot de nouvelles connaissances, notamment sur les mécanismes qui contrôlent la mise en place du système nerveux central.
Pour aller plus loin
Irène Aksoy, Cloé Rognard, Anaïs Moulin, Guillaume Marcy, Etienne Masfaraud, Florence Wianny, Véronique Cortay, Angèle Bellemin-Ménard, Nathalie Doerflinger, Manon Dirheimer, Chloé Mayère, Pierre-Yves Bourillot, Cian Lynch, Olivier Raineteau, Thierry Joly, Colette Dehay, Manuel Serrano, Marielle Afanassieff, Pierre Savatier,
Apoptosis, G1 Phase Stall, and Premature Differentiation Account for Low Chimeric Competence of Human and Rhesus Monkey Naive Pluripotent Stem Cells, Stem Cell Reports, Volume 16, Issue 1, 2021, Pages 56-74.
Projet de loi relatif à la bioéthique, texte définitif adopté par l’Assemblée nationale le 29 juin 2021.







