Des chercheurs lyonnais sont parvenus à reprogrammer des cellules gliales en cellules neuronales chez des souris souffrant d’épilepsie. La régénération des neurones détruits leur a permis de réduire de moitié les crises. Post-doctorantes dans l’équipe à l’origine de l’étude, Célia Lentini et Marie d’Orange nous présentent cette stratégie prometteuse.
De nombreuses pathologies du système nerveux central, telles les maladies d’Alzheimer, de Parkinson ou certaines formes d’épilepsie, sont associées à une dégénérescence des neurones. Or le cerveau n’est capable ni de les réparer ni de les remplacer. Serait-il possible de régénérer ces neurones perdus ? Telle est la question à laquelle une équipe de chercheurs de l’Institut cellule souche et cerveau (SBRI) de Lyon en collaboration avec le King’s College de Londres a récemment répondu.
Les chercheurs se sont intéressés à l’épilepsie, deuxième pathologie neurologique en France, qui est associée à une dégénérescence neuronale. Et plus spécialement à l’épilepsie mésiotemporale, une des formes les plus fréquentes d’épilepsie focale de l’adulte et pour laquelle de nombreux patients sont, ou deviennent, résistants à toute forme de traitement existant. Ils ont choisi de travailler avec un modèle murin (souris) bien décrit dans la littérature et qui reproduit l’essentiel des caractéristiques de l’épilepsie mésiotemporale humaine, incluant entre autre une dégénérescence des neurones inhibiteurs de l’hippocampe (lire ci-dessous).
A quoi servent les neurones inhibiteurs ?
Le terme « neurones inhibiteurs » est en fait un raccourci pour parler des neurones possédant des neurotransmetteurs inhibiteurs (GABA, glycine). Ces neurotransmetteurs sont relâchés dans la fente synaptique et vont aller empêcher le déclenchement d’un influx nerveux dans le neurone adjacent. Cela permet donc de réduire, voir complètement supprimer, le message nerveux de ce second neurone. En d’autres termes, ce phénomène permet de réguler l’excitation des neurones et de limiter les suractivations pathologiques.
> Lire notre article : Pourquoi la recherche sur la synapse reste essentielle.
Les chercheurs ont utilisé une stratégie innovante de reprogrammation cellulaire directe permettant de convertir l’identité de cellules non neuronales en neurones. Dans cette étude, ils ont exploité les cellules gliales présentes en abondance au voisinage des neurones endommagés et les ont reprogrammées en neurones inhibiteurs, capables d’enrayer les crises épileptiques. Pour cela, ils ont injecté des vecteurs viraux (virus désactivés) transportant des facteurs de transcription impliqués dans la neurogénèse (production de neurones endogènes au cours du développement) au sein de l’hippocampe.
Ce procédé permet de diviser par deux le nombre de crises chez les souris épileptiques.
L’expression de ces facteurs permet de « forcer » les cellules gliales à se reprogrammer en neurones, qu’on appelle alors neurones « induits » (pour les différencier des neurones endogènes). Leurs résultats montrent une reprogrammation des cellules gliales en neurones avec une grande efficacité. En outre, les nouveaux neurones possèdent des propriétés d’inhibition comparables aux neurones disparus. Ces nouveaux neurones sont capables de s’intégrer dans le réseau de neurones de l’hippocampe et de réduire directement l’activité des neurones responsables des crises. Ce procédé permet de diviser par deux le nombre de crises chez les souris épileptiques.
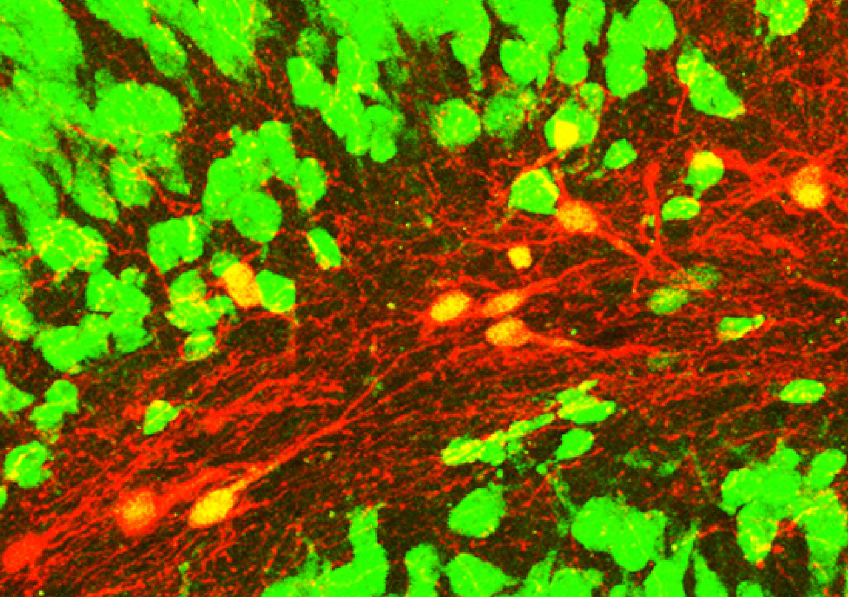
Ces résultats sont porteurs d’espoir pour le traitement de l’épilepsie chez l’homme, mais également, à plus grande échelle, pour le traitement des pathologies neurodégénératives. Il reste toutefois de nombreuses étapes avant de parvenir à une transposition de la reprogrammation cellulaire directe chez l’homme.
Quelles seront les prochaines étapes à franchir ? Cette stratégie présente-t-elle des limites ? Nous avons interrogé Célia Lentini et Marie d’Orange, post-doctorantes au sein de l’équipe Cellular reprogramming in the brain de Christophe Heinrich, à l’origine de cette étude.
Quel est le temps nécessaire à la reprogrammation des cellules gliales en neurones ?
Des études précédentes, notamment in vitro, ont montré que le processus de reprogrammation est progressif mais qu’il peut être assez rapide. En utilisant une méthode d’imagerie en temps réel, les premiers changements morphologiques ont ainsi pu être observés 48 heures après l’infection de cellules gliales. D’ailleurs, dans la même étude1, il avait été montré qu’il existe un stade où les cellules reprogrammées peuvent exprimer de manière concomitante des marqueurs gliaux et neuronaux, signe de leur « passé » de cellules gliales et que le phénomène observé est bien une conversion directe de cellules non neuronales en neurones. Le processus est rapide également in vivo puisque nous avons montré dans l’étude que, dès 7 jours après l’injection, environ 60% des cellules expriment déjà DCX, un marqueur de neurones immatures. En revanche, la maturation, c’est-à-dire le moment où la cellule gliale reprogrammée devient un neurone fonctionnel, prend plus de temps. Dans notre étude, 7 jours après l’injection, on a seulement quelques neurones matures (18%). Par contre, à un mois, environ 60% des cellules ayant reçu les facteurs de transcription expriment NeuN, un marqueur de neurones matures.
Cette reprogrammation est-elle transposable chez l’homme ? Quelles sont les obstacles à franchir pour arriver à une application clinique viable ?
On n’est encore qu’au début de ces recherches. Il est donc un peu précipité d’envisager de les transposer chez l’homme dans un futur proche, mais il s’agit évidemment de la finalité visée. Point encourageant, d’autres études ont déjà permis de démontrer qu’il était faisable de reprogrammer des cellules cérébrales humaines cultivées in vitro2 en neurones induits, confirmant que l’approche est envisageable chez l’homme. Parmi les défis à relever avant d’appliquer cette stratégie chez les patients, il conviendra notamment de trouver la meilleure formulation pour délivrer de manière sure, spécifique et non toxique les facteurs de transcription aux cellules à reprogrammer (vecteur viral ou autre approche). D’autres recherches devront aussi être menées pour déterminer si la reprogrammation cellulaire peut être généralisée à d’autres pathologies, notamment les maladies neurodégénératives, pour lesquelles le défi principal à relever sera de déterminer si les neurones induits peuvent faire face dans un contexte où la maladie continue à progresser.
Cette reprogrammation peut-elle avoir des effets délétères ?
Notre étude a démontré que la reprogrammation cellulaire peut avoir un effet bénéfique dans le contexte de l’épilepsie. Nous n’avons pas observé d’effet délétère, mais cela reste à étudier. Une question qui peut se poser, par exemple, est l’impact de la reprogrammation des cellules gliales en neurones, ces cellules gliales ayant elles-mêmes une fonction dans le cerveau. En effet, dans de nombreuses maladies cérébrales, les cellules gliales prolifèrent en réponse à la lésion. La cellule source étant présente en abondance, on peut supposer qu’en reprogrammer certaines n’aurait pas d’effet délétère sur leur fonction. Par ailleurs, la prolifération de ces cellules gliales dites réactives pouvant dans certains cas avoir un effet délétère, leur reprogrammation pourrait ainsi avoir un effet doublement bénéfique. De nouvelles études sont donc nécessaires pour déterminer l’impact de la reprogrammation des cellules gliales sur le microenvironnement cérébral et l’homéostasie tissulaire.
Références
- Lentini et al (2021), Cell Stem Cell, Reprogramming reactive glia into interneurons reduces chronic seizure activity in a mouse model of mesial temporal lobe epilepsy.
- (1) Gascon, 2016, Cell Stem Cell.
- (2) Karow, 2012, Cell Stem Cell ; Karow, 2018, Nature Neuroscience.