Maladie de Parkinson, autisme, épilepsie, myasthénies : la synapse est impliquée dans de nombreuses maladies. Mieux comprendre sa structure et la nature de ses dysfonctionnements est essentiel pour proposer de nouveaux traitements aux personnes atteintes par ces pathologies.
Un être humain possède de l’ordre de 100 milliards de neurones, connectés entre eux par 10 000 fois plus de synapses. On parvient ainsi au chiffre astronomique de 1 million de milliards de synapses ! Cette structure microscopique de 20 nanomètres (3 000 fois plus petit qu’un cheveu) permet de connecter un neurone à une autre cellule, la plupart du temps un autre neurone. Elle assure que l’information transportée par le neurone soit transmise malgré la discontinuité entre les deux cellules indépendantes. Il existe plusieurs types de synapses, mais la plus célèbre est la synapse chimique, qui utilise des molécules messagères pour franchir l’espace qui sépare les deux cellules (lire l’encadré ci-dessous pour une description plus détaillée du mécanisme).
Comment fonctionne une synapse chimique
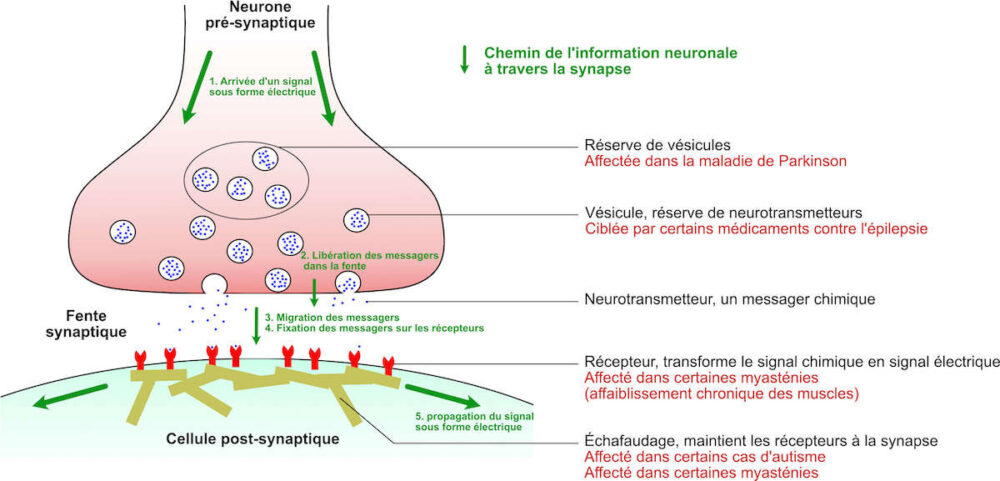
- Un signal électrique arrive en se propageant le long du neurone présynaptique.
- Ce signal électrique entraîne la libération de messagers chimiques dans la fente synaptique, l’espace entre les deux cellules. Les messagers chimiques, aussi appelés neurotransmetteurs, sont contenus dans des petites poches appelées vésicules. Lors du passage de l’information, les vésicules migrent à la surface du neurone et viennent libérer leurs messagers.
- Les messagers migrent à travers l’espace entre les cellules par diffusion, un simple déplacement au hasard de particules dans un liquide.
- Les messages chimiques se fixent à leurs récepteurs associés, qui créent alors une impulsion électrique.
- L’impulsion électrique nouvellement créée se propage le long de la cellule post-synaptique.
- La synapse peut moduler l’intensité du signal transmis en ajustant sa taille, la densité des récepteurs, ou la quantité de messagers libérée. Ce phénomène fait partie de la plasticité cérébrale et permet l’apprentissage. Lors d’une pathologie cérébrale, les synapses sont bien souvent touchées et ce à des endroits différents.
Pour le cerveau, ces discontinuités entre neurones sont d’un très grand intérêt : il peut à tout moment changer la position des synapses et en modifier individuellement l’efficacité pour changer l’information transmise d’un neurone à l’autre. Malheureusement, la synapse est aussi très fragile. La moindre modification dans sa composition peut avoir des conséquences dramatiques à l’échelle de l’organisme !
Le point commun entre la maladie de Parkinson, l’autisme, l’épilepsie ou les myasthénies ? Elles résultent toutes d’un dysfonctionnement de la synapse. Ces dysfonctionnements peuvent avoir une cause génétique ou être liés à un accident vasculaire ou encore au vieillissement des cellules.
Si l’on connait dans ses grandes lignes le fonctionnement de la synapse, cela n’est pas suffisant pour expliquer toutes les maladies observées. C’est pourquoi des chercheurs du monde entier continuent de mener des travaux pour mieux comprendre la synapse et proposer de nouveaux traitements. Chaque semaine, des articles scientifiques paraissent pour partager des découvertes sur des détails jusqu’alors inconnus : une interaction entre deux molécules que l’on croyait indépendantes ; une nouvelle molécule, voire une idée de traitement découlant d’informations partagées par d’autres. Ainsi, on a récemment élucidé le rôle d’une protéine permettant de limiter la destruction synaptique.
Nous vous proposons ici un état succinct des connaissances sur l’implication de la synapse dans quelques maladies et sur les traitements existants ou envisagés pour y remédier.
La synapse dans la maladie de Parkinson
A ce jour, on ne sait pas soigner la maladie de Parkinson. Il existe seulement des traitements pour en alléger certains symptômes, dont certains très innovants comme l’implantation de cellules souches dans le cerveau (lire ci-dessous). Les scientifiques s’intéressent notamment à l’alpha-synucléine, une protéine essentielle au développement de la pathologie. Cette molécule, normalement impliquée dans les mouvements de vésicules contenant les messagers chimiques dans le neurone présynaptique, s’agrège avec elle-même dans de nombreux cas de la maladie, ce qui altère sa fonction. La dynamique de libération des messagers chimiques dans la fente synaptique est alors perturbée, et la synapse ne fonctionne plus correctement. Des effets divers, allant d’une simple fatigue à une altération de la vision, peuvent apparaître à ce stade.
Ce dysfonctionnement provoque aussi une dégénérescence des neurones dits dopaminergiques (car ils utilisent la dopamine comme messager chimique). Ces neurones sont notamment impliqués dans le contrôle du mouvement. Leur altération est à l’origine de symptômes moteurs, comme le tremblement caractéristique de la maladie de Parkinson. La plupart des traitements proposés aujourd’hui visent à stimuler les neurones dopaminergiques et à limiter leur dégénérescence. Mais on ne sait pas encore traiter le problème à la source : dans les cas où elle est impliquée, comment faire pour que l’alpha-synucléine se remette à fonctionner normalement ? Trouver une réponse à cette question permettrait d’éviter une grande partie des symptômes de la maladie.
Sur le même sujet : Maladie de Parkinson : que penser de l’implantation de cellules souches iPS dans le cerveau ?
La synapse dans l’autisme
Il est difficile de parler d’une cause unique de l’autisme tant les origines de ce trouble sont diverses. Dans de nombreux cas la synapse est touchée, mais le grand nombre de mutations pouvant participer à l’apparition de l’autisme rend une explication unique impossible. Les scientifiques ont cependant réussi à trouver une explication qui correspondrait à environ 1% des cas. Ici, c’est la cellule post-synaptique qui est touchée. Le dysfonctionnement concerne des molécules essentielles à l’échafaudage qui tient les récepteurs en place (voir l’infographie) : il s’agit de protéines de la famille Shank. Lorsqu’une de ces protéines est mutée, les récepteurs du messager chimique ne sont plus maintenus correctement et ne peuvent plus remplir leur rôle. Le message chimique, pourtant ici émis correctement, n’est alors plus correctement transformé en message électrique et transmis. Cette variation suffit à créer des dysfonctionnements à l’échelle du cerveau et participe à l’apparition de certains symptômes de l’autisme, comme les déficits dans la communication et les relations sociales. Les scientifiques ne savent pas encore corriger ces défauts fonctionnels des protéines Shank. On imagine qu’il serait envisageable, grâce au développement des thérapies géniques, de corriger dans l’ADN des patients les mutations causant le dysfonctionnement synaptique.
Sur le même sujet : Digitrack : un outil innovant pour la détection précoce de l’autisme.
La synapse et l’épilepsie
Bien que l’épilepsie recouvre de nombreuses pathologies, celles-ci ont en commun l’apparition de crises caractérisées par un emballement de l’activité cérébrale. Le modèle principal expliquant ces crises parle d’un déséquilibre entre excitation et inhibition des neurones. Selon le type de messager chimique et la position d’une synapse, celle-ci peut jouer un rôle différent sur la cellule post-synaptique. Ainsi, dans le cerveau, si le messager est du GABA, la synapse va jouer un rôle inhibiteur : le message transmis sera d’arrêter les autres messages passant près de la synapse. Au contraire, si le messager chimique est du glutamate, la synapse sera excitatrice : le message transmis sera une impulsion électrique. Dans le cas de l’épilepsie, un déséquilibre entre la force fournie par ces deux synapses se produit. Il y a trop de signaux excitateurs, liés au glutamate, et pas assez de signaux inhibiteurs, liés au GABA. Les scientifiques ont proposé plusieurs solutions pour améliorer les conditions des patients épileptiques. On peut citer notamment le médicament Levetiracetam, qui a la propriété de réduire la quantité de glutamate émise aux synapses excitatrices. Moins d’excitation de la part des synapses excitatrices permet de rééquilibrer la balance avec le GABA, inhibiteur, et ainsi de réduire la fréquence des crises épileptiques.
Sur le même sujet : Épilepsie : les avancées de la recherche sur une maladie mystérieuse.
La synapse et les myasthénies
Caractérisées généralement par des faiblesses musculaires chroniques, les myasthénies sont liées à des atteintes de la synapse neuromusculaire (qui assure la jonction entre un neurone et un muscle). Celle-ci permet qu’un ordre de contraction donné par le système nerveux soit correctement transmis au muscle et entraîne une contraction. Lorsque cette structure est dysfonctionnelle, la contraction volontaire des muscles devient impossible. Le cerveau a beau donner des ordres de contraction, le muscle ne réagit plus.
C’est ce qui se passe dans le cas de la Myasthenia Gravis, ou myasthénie autoimmune. Les patients atteints de cette maladie voient leur système immunitaire attaquer leurs récepteurs post-synaptiques. Il y a alors moins de récepteurs à la synapse neuromusculaire, et ceux-ci sont moins fonctionnels. Il en résulte que les muscles ne peuvent plus se contracter. Cette maladie peut devenir très grave et mortelle quand le système respiratoire est touché. Elle concerne plusieurs milliers de personnes en France.
Des chercheurs à l’université Claude-Bernard Lyon 1 mènent actuellement des recherches pour mieux comprendre les mécanismes de cette maladie. Pour cela, ils utilisent les synapses neuromusculaires du ver C. Elegans, lesquelles présentent de nombreuses similarités avec celles des humains. Elles utilisent notamment le même messager chimique, l’acétylcholine, ainsi que des récepteurs similaires. Les chercheurs ont découvert des vers avec des mutations qui ont les mêmes conséquences que dans certaines myasthénies : les récepteurs ne se localisent plus aux synapses mais sur toute la surface des cellules musculaires, avec pour conséquence une transmission du signal beaucoup moins efficace. À l’instar des êtres humains affectés, les vers ont du mal à contracter leurs muscles. Les chercheurs cherchent à mieux comprendre ces mécanismes pour permettre à terme de proposer de nouveaux traitements pour les myasthénies.
Sources
Revues générales
Lepeta, K. et al. (2016) ‘Synaptopathies: synaptic dysfunction in neurological disorders – A review from students to students’, Journal of Neurochemistry, 138(6), pp. 785–805. doi: 10.1111/jnc.13713.
van Spronsen, M. and Hoogenraad, C. C. (2010) ‘Synapse Pathology in Psychiatric and Neurologic Disease’, Current Neurology and Neuroscience Reports, 10(3), pp. 207–214. doi: 10.1007/s11910-010-0104-8.
Taoufik, E. et al. (no date) ‘Synaptic dysfunction in neurodegenerative and neurodevelopmental diseases: an overview of induced pluripotent stem-cell-based disease models’, Open Biology, 8(9), p. 180138. doi: 10.1098/rsob.180138.
Parkinson
Bellucci, A. et al. (2016) ‘Review: Parkinson’s disease: from synaptic loss to connectome dysfunction’, Neuropathology and Applied Neurobiology, 42(1), pp. 77–94. doi: 10.1111/nan.12297.
Picconi, B., Piccoli, G. and Calabresi, P. (2012) ‘Synaptic dysfunction in Parkinson’s disease’, Advances in Experimental Medicine and Biology, 970, pp. 553–572. doi: 10.1007/978-3-7091-0932-8_24.
Soukup, S.-F., Vanhauwaert, R. and Verstreken, P. (2018) ‘Parkinson’s disease: convergence on synaptic homeostasis’, The EMBO Journal, 37(18), p. e98960. doi: 10.15252/embj.201898960.
Épilepsie
Casillas-Espinosa, P. M., Powell, K. L. and O’Brien, T. J. (2012) ‘Regulators of synaptic transmission: roles in the pathogenesis and treatment of epilepsy’, Epilepsia, 53 Suppl 9, pp. 41–58. doi: 10.1111/epi.12034.
Jefferys, J. G. R. (2010) ‘Advances in understanding basic mechanisms of epilepsy and seizures’, Seizure, 19(10), pp. 638–646. doi: 10.1016/j.seizure.2010.10.026.
Autisme
Leblond, C. S. et al. (2014) ‘Meta-analysis of SHANK Mutations in Autism Spectrum Disorders: A Gradient of Severity in Cognitive Impairments’, PLOS Genetics, 10(9), p. e1004580. doi: 10.1371/journal.pgen.1004580.
Monteiro, P. and Feng, G. (2017) ‘SHANK proteins: roles at the synapse and in autism spectrum disorder’, Nature Reviews Neuroscience, 18(3), pp. 147–157. doi: 10.1038/nrn.2016.183.
Myasténies
Ha, J. C. and Richman, D. P. (2015) ‘Myasthenia gravis and related disorders: Pathology and molecular pathogenesis’, Biochimica et Biophysica Acta (BBA) – Molecular Basis of Disease, 1852(4), pp. 651–657. doi: 10.1016/j.bbadis.2014.11.022.
Phillips, L. H. (2003) ‘The Epidemiology of Myasthenia Gravis’, Annals of the New York Academy of Sciences, 998(1), pp. 407–412. doi: https://doi.org/10.1196/annals.1254.053.
Phillips, W. D. and Vincent, A. (2016) ‘Pathogenesis of myasthenia gravis: update on disease types, models, and mechanisms’, F1000Research, 5. doi: 10.12688/f1000research.8206.1.
Plomp, J. J., Huijbers, M. G. M. and Verschuuren, J. J. G. M. (2018) ‘Neuromuscular synapse electrophysiology in myasthenia gravis animal models’, Annals of the New York Academy of Sciences, 1412(1), pp. 146–153. doi: 10.1111/nyas.13507.
Vilquin, J.-T. et al. (2019) ‘The Muscle Is Not a Passive Target in Myasthenia Gravis’, Frontiers in Neurology, 10. doi: 10.3389/fneur.2019.01343.







