Ce médecin neurobiologiste s’efforce de comprendre comment fonctionne la douleur physique chez l’homme, ouvrant la voie à de nouvelles perspectives thérapeutiques.
«La douleur est une bonne chose, assure sans crainte du paradoxe le neurobiologiste Luis Garcia-Larrea, chercheur à l’Inserm et à l’hôpital neurologique de Lyon. Sans elle nous ne pourrions tout simplement pas survivre.» La douleur est en effet un système d’alarme parmi les plus fondamentaux de la vie. On le retrouve chez les organismes les plus anciens ou rudimentaires : même une paramécie est sensible à ce qui pourrait la détruire ; c’est, par exemple, ce qui lui permet de fuir lorsqu’elle entre en contact avec un milieu acide. De la même manière, les vers ou les mollusques repèrent les stimulations potentiellement nocives grâce à des terminaisons nerveuses spécifiques situées dans la peau ou les muqueuses, appelées nocicepteurs – du latin nocere et capere, qui ont respectivement donné nuisible et capter.
Luis Garcia-Larrea consacre ses recherches à l’ensemble du système nociceptif chez l’homme, allant des premières sensations désagréables à l’analyse qui en est faite par le cerveau et aux réactions qui en découlent. Il a tout récemment reçu un prix de l’Institut de France pour ses travaux sur «l’expérience douloureuse chez l’homme», après avoir été récompensé, en 2009, par la Fondation NRJ pour ses recherches sur la douleur et ses traitements. Farouche défenseur de la recherche fondamentale, il estime qu’on ne peut traiter la douleur qu’en connaissance de cause : «Ce n’est qu’en bout de chaîne, et sans forcément l’avoir cherché, que l’on peut en déduire des processus thérapeutiques.»
Arrivé à Lyon en 1985, après un internat de médecine à Barcelone, il a commencé ses recherches sur un thème presque plus fondamental – la somesthésie, ou perception du monde à travers le corps – avant de se spécialiser dans les sensations désagréables. «Quand vous étudiez la douleur, s’enthousiasme-t-il, vous accédez à tous les états cognitifs : l’anticipation, la focalisation, la mémoire, l’angoisse… C’est une fenêtre ouverte sur toutes les activités du cerveau.»
Il n’y a pas de «centre de la douleur»
Depuis les années 1990, la connaissance du système nociceptif de l’homme a fait des bonds de géant grâce à l’électrophysiologie et l’imagerie cérébrale. Contrairement à ce qui a été supposé pendant des siècles, la douleur n’est pas le simple résultat d’une sensation extrême ou trop forte, mais implique au contraire des systèmes très spécialisés véhiculant l’information de la périphérie jusqu’au cerveau. Les zones du cerveau qui réceptionnent cette information différent selon l’intensité de celle-ci : «Si on vous caresse la main, l’essentiel de l’information est analysée dans le cortex somato-sensoriel primaire, détaille Luis Garcia-Larrea ; et si on vous brûle les doigts, l’activité se concentre dans le cortex insulaire, qui est d’ailleurs une structure plus ancienne du cerveau.» Pour autant, il n’y a pas de «centre de la douleur». «Une quinzaine de régions neuronales s’activent suivant un ordre strict et, là encore, très différent d’une sensation banale.»
«Imaginons qu’une guêpe vous pique au bras, poursuit Luis Garcia-Larrea : l’information est repérée par les nocicepteurs et arrive au cerveau par plusieurs chemins.» Un des systèmes atteint le thalamus, qui est une sorte de «gare de triage» des informations sensorielles, d’où le message nociceptif est envoyé simultanément à plusieurs zones, sensorielles et motrices. A ce moment-là, il n’y a pas encore de prise de conscience. Autrement dit : on retire vivement son bras, on crie, on regarde à l’endroit de la piqûre… avant même de comprendre ce qui se passe. Dans le même temps, d’autres systèmes court-circuitent le thalamus et envoient le message nociceptif vers le système limbique du cerveau – le noyau amygdalien, dédié aux émotions – qui intègre une sensation de désagrément. «C’est une triade, résume le chercheur : sensorielle, motrice et affective. Elle constitue l’embryon de ce que nous appelons la “matrice de la douleur” », le point départ physiologique à partir duquel nous allons progressivement pouvoir penser : “j’ai mal”.»
Pour certaines pathologies, les antidouleurs ne servent à rien
Avec ses collègues, Luis Garcia-Larrea cherche à comprendre comment l’on passe des étapes inconscientes à la perception consciente de la douleur. Les chercheurs de l’équipe Neuropain, au Centre de recherche en neurosciences de Lyon, procèdent pour cela à des stimulations électro-physiologiques sur des sujets sains : ils analysent, par exemple, le comportement du cerveau pendant que des sensations de chaleur vives et rapides sont appliquées. «On mesure aussi l’impact des phénomènes cognitifs sur la perception de la douleur, poursuit Luis Garcia-Larrea. Si vous jouez à un jeu vidéo ou faites du calcul mental au moment où vous vous faites mal, vous le ressentirez moins rapidement et moins fort.» À l’inverse, voir des photos de personnes souffrantes a tendance à accentuer la douleur, ce qu’on appelle hyperalgésie compassionnelle. «Malheureusement, plaisante-t-il, ça n’a l’air de marcher que dans ce sens : être exposé à des images de gens heureux ne vous permet pas d’aller mieux.»
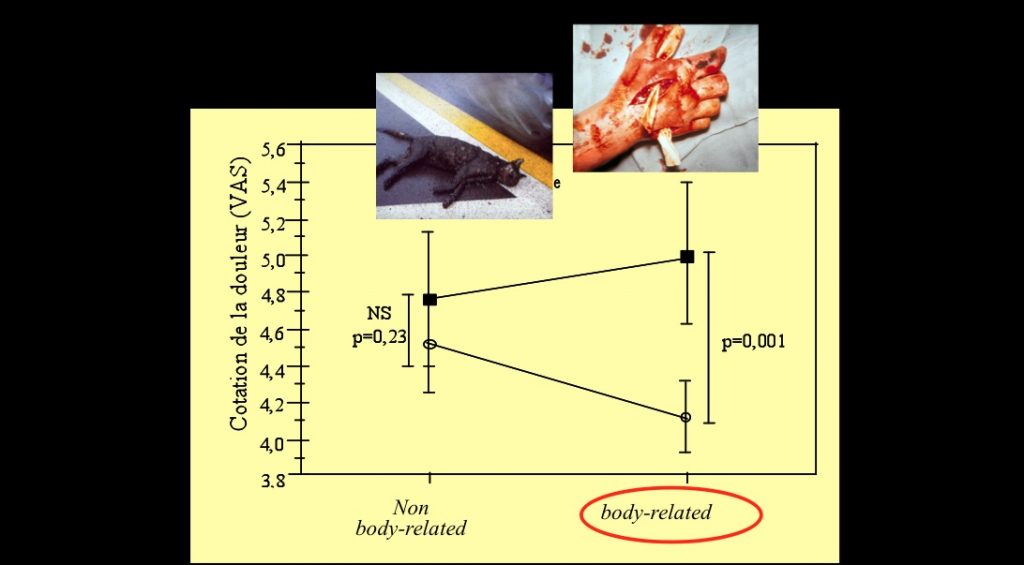
Recevoir un stimulus douloureux alors qu’on regarde des images désagréables rend la sensation plus douloureuse, surtout si ces images montrent la souffrance de quelqu’un d’autre. On appelle cela l’hyperalgésie compassionnelle. Sur ce schéma, on voit que la perception de la douleur est plus importante pour l’image de la main broyée que pour le chat mort.
Son laboratoire étudie également la souffrance pathologique dans l’espoir d’ouvrir la voie à de nouvelles thérapies. Certains patients diabétiques souffrent ainsi de douleurs neuropathiques : ils sentent moins bien leurs mains ou leurs pieds, et éprouvent en même temps comme une brûlure à ces mêmes endroits. Une situation d’autant plus handicapante que les antidouleurs et même la morphine n’ont que très peu d’effet. «Ces souffrances semblent être dues à une série de mécanismes que le système nerveux enclenche pour se régénérer, suppose Luis Garcia-Larrea. Cela expliquerait à la fois la perte de sensation et la douleur.» Autrement dit, le diabète, comme d’autres affections, endommage le système nerveux, lequel réagit en tentant de rétablir la transmission sécrétant des facteurs de croissance, créant des nouveaux canaux ioniques dans les nerfs et activant toute une machinerie réparatrice ; mais tout cela active au passage des neurotransmetteurs associés à la douleur. Des mécanismes similaires expliqueraient d’ailleurs les souffrances dites «fantômes», lorsqu’un individu amputé a mal au bras ou à la jambe qu’il ne possède plus.
Demain, la neurostimulation pour tous ?
À défaut d’avoir un traitement clé en main, Luis Garcia-Larrea juge possible d’améliorer la prévention. «On sait que 30 à 40 % des personnes ayant fait certains AVC souffriront de problèmes neuropathiques – et beaucoup sont diagnostiquées très tard, après avoir pris des antidouleurs qui ne leur servent à rien.» Pendant ce temps, le problème s’est consolidé et s’avère d’autant plus difficile à traiter. L’idéal, dans un premier temps, serait de les aider en amont en repérant les profils les plus à risques. «Nous y sommes parvenus récemment, mais a postériori», relève le chercheur : en reprenant les dossiers de patients diagnostiqués pour analyser leur situation juste après un AVC thalamique, il pense avoir repéré des singularités permettant d’anticiper le développement de douleurs neuropathiques. «Le calcul statistique fonctionne bien, mais nous connaissions déjà le résultat, explique-t-il. Nous espérons à l’avenir vérifier des prédictions faites en amont, ce qui nous permettra au passage de mieux surveiller des patients à risque.»
Des traitements plus opérationnels sont aussi à l’étude, mais relèvent encore du prototype, voire de la science-fiction. «L’optogénétique, par exemple, offre des pistes prometteuses», se réjouit Luis Garcia-Larrea. L’idée générale est d’utiliser des faisceaux lumineux pour activer certaines cellules neuronales sans toucher les autres : cela permettrait, par exemple, de stimuler la régénération du système nerveux sans enclencher les neurotransmetteurs associés à la douleur. Sur le plan de la thérapeutique, son laboratoire travaille essentiellement sur des thérapies par neurostimulation comme alternative à la pharmacologie – et sans les effets secondaires… «Ces techniques sont de moins en moins invasives : les chercheurs ont appris à utiliser des stimulations magnétiques pour stimuler des zones du cerveau susceptibles de bloquer elles-mêmes la douleur.» D’ici dix à quinze ans, un patient pourrait même posséder son propre casque doté d’électrodes, et effectuer lui-même des stimulations en suivant son ordonnance. «Pour l’instant, nous devons prouver que ça marche et que c’est inoffensif, mais j’ai bon espoir.» Après tout, il n’y a pas si longtemps les casques de réalité virtuelle relevaient aussi de la science-fiction, et ils sont bien devenus grand public.
 Tout ce que vous avez toujours voulu savoir sur la douleur et la conscience
Tout ce que vous avez toujours voulu savoir sur la douleur et la conscience
C’est une somme unique en son genre : 30 spécialistes mondiaux réunis sous la direction de Luis Garcia-Larrea et du neuropsychologue Philip L. Jackson pour écrire Pain and the Conscious Brain. «Nous avons voulu explorer les rapports entre la conscience de soi, du monde et la perception douloureuse», résume Luis Garcia-Larrea. En ligne de mire : l’homme, seul être vivant à pouvoir se penser lui-même – d’où son surnom d’espèce homo sapiens sapiens, «sachant qu’il sait». «Notre point de départ est l’idée que cette conscience de soi induit un rapport très particulier à la douleur, unique à l’homme.» Lorsqu’on a mal au ventre, par exemple, on commence par se demander pourquoi. «Si vous trouvez une réponse, la douleur diminue ; et si vous l’ignorez, vous allez au contraire ruminer et vous inquiéter… On ne retrouve pas de tels états cognitifs chez les animaux. Ça ne veut pas dire qu’ils ne souffrent pas, mais le fonctionnement est différent.» Plus qu’une synthèse de connaissances, l’ouvrage aborde des questions d’actualité et de prospective : une roboticienne se demande ainsi s’il serait possible d’implanter un système de douleur analogue chez un androïde…
Pain and the Conscious Brain, ouvrage collectif sous la direction de Luis Garcia-Larrea et Philip L. Jackson (Wolters Kluwer).









