Une équipe lyonnaise vient de montrer que la greffe de précurseurs neuraux dans plusieurs zones lésées du cerveau permet de rétablir un réseau fonctionnel et de réduire les symptômes moteurs et cognitifs liés à la maladie. Un résultat prometteur pour les essais cliniques en cours.
La maladie de Parkinson touche plus de 160 000 personnes en France, ce qui en fait la deuxième maladie dégénérative la plus fréquente après la maladie d’Alzheimer. Cette affection progressivement invalidante est une cause majeure de handicap chez les personnes âgées. Aujourd’hui, la prise en charge des patients repose principalement sur l’administration de lévodopa, un précurseur de la dopamine (lire l’encadré ci-dessous) qui permet de compenser les effets liés à la neurodégénérescence, et celle de médicaments destinés à soulager les symptômes non moteurs de la maladie. Depuis une trentaine d’années, la recherche poursuit trois objectifs : mieux comprendre les mécanismes neurologiques associés aux différents symptômes, ralentir la dégénérescence neuronale et compenser la perte des neurones lésés. C’est dans ce cadre qu’une équipe de l’Institut Cellule Souche et Cerveau (SBRI, Inserm Lyon) a publié une étude de preuve de concept montrant que la greffe de précurseurs neuraux (cellules pluripotentes pouvant générer des neurones, des astrocytes et des oligodentrocytes) dans le cerveau de singes parkinsoniens permettait de rétablir un réseau neuronal fonctionnel et de réduire considérablement les symptômes de la maladie.
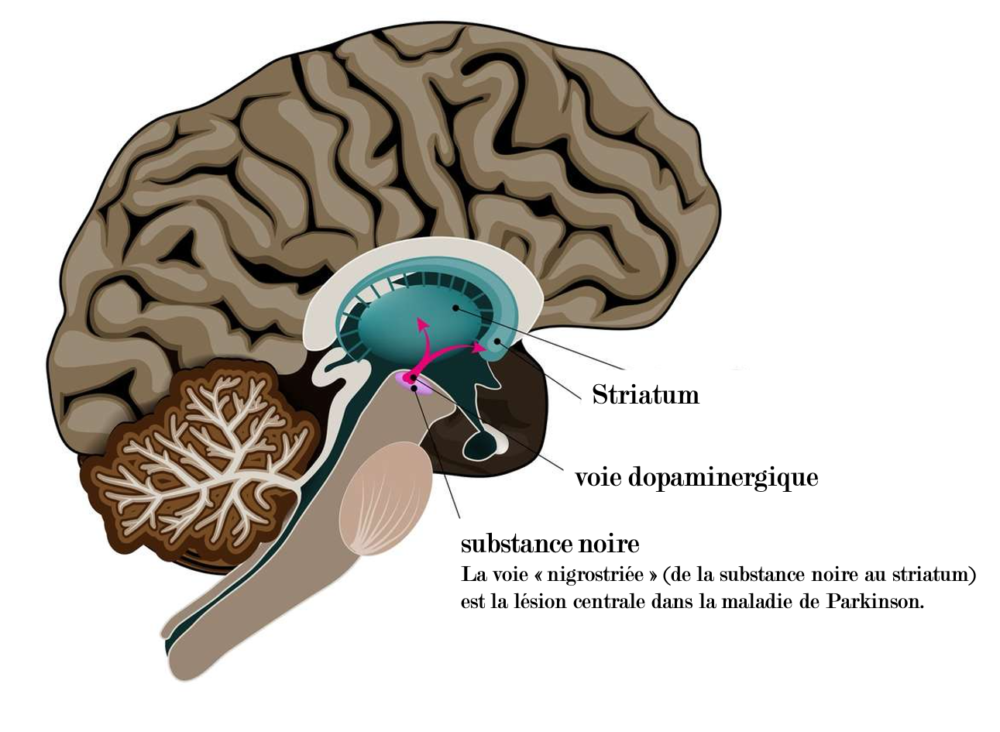 La maladie de Parkinson, une maladie neurodégénérative
La maladie de Parkinson, une maladie neurodégénérative
Considérée comme l’une des dégénérescences majeures du système nerveux, la maladie de Parkinson est notamment caractérisée par une destruction progressive et ciblée des neurones dopaminergiques de la substance noire (appartenant aux ganglions de la base) du cerveau. Ces neurones dopaminergiques produisent un neurotransmetteur, la dopamine, impliquée dans de nombreuses fonctions (contrôle moteur, exécutif, émotionnel, sommeil, etc.). Selon l’étendue des lésions neurologiques, différentes phases symptomatiques se succèdent. Le stade prémoteur se traduit par des symptômes dits non moteurs, qui incluent des troubles des fonctions cognitives, en particulier les fonctions exécutives et la mémoire. Les symptômes s’aggravent avec la progression de la lésion neurologique. Au stade clinique de la maladie, de 60 à 80% des neurones dopaminergiques sont déjà perdus. Les symptômes moteurs caractéristiques surviennent : rigidité des membres, troubles posturaux, tremblements, lenteur à l’exécution et pertes d’équilibre, entre autres. Le diagnostic médical est donc posé très tardivement par rapport au niveau de la lésion, après l’installation de symptômes moteurs invalidants pour le patient.
> En savoir plus sur la maladie de Parkinson (site de l’Inserm).
Les enjeux de la recherche sur la maladie de Parkinson sont multiples. Au niveau clinique, l’objectif est de détecter la maladie de façon précoce, à partir des signes non moteurs (troubles du cycle veille-sommeil, troubles cognitifs…) à l’aide de tests neuropsychologiques, voire de tests sanguins (comme l’ont récemment montré deux chercheuses de l’Institut des neurosciences de Grenoble) ou encore d’examens du système digestif. Dans le même temps, la recherche fondamentale essaie de comprendre les mécanismes neurologiques impliqués dans la maladie pour développer des techniques permettant de réduire ou de compenser la dégénérescence neuronale observée au niveau de la substance noire. Pour cela, elle s’appuie sur un modèle reproduisant le syndrome parkinsonien et la lésion des neurones dopaminergiques de la substance noire chez le singe par injection d’une molécule connue sous le nom de MPTP.
 Comment on a découvert les effets du MPTP
Comment on a découvert les effets du MPTP
En 1982, en Californie, sept individus, plutôt jeunes et sans antécédents cliniques, se sont réveillés un matin en présentant tous les symptômes moteurs et certains troubles cognitifs caractéristiques d’un stade avancé de Parkinson. Une enquête a permis d’identifier la cause de ce phénomène étrange : la consommation de MPTP, une neurotoxine produite accidentellement lors de la fabrication illicite de MPPP, une sorte d’héroïne synthétique. L’examen post-mortem du cerveau d’un des patients a révélé une dégénérescence très localisée des neurones dopaminergiques de la substance noire. Cette découverte a révolutionné la recherche sur Parkinson en permettant le développement de modèles animaux MPTP de la maladie et de réaliser rapidement des essais précliniques sur ces modèles.
> En savoir plus sur le MPTP.
La recherche sur le modèle singe, dans le respect du code éthique de l’Inserm, représente un apport majeur dans la compréhension de la maladie et l’évolution des stratégies thérapeutiques. En effet, en modulant la dose injectée de MPTP, on a pu retracer les différents stades de la maladie et mesurer le degré de lésion des neurones dopaminergiques de la substance noire.
Pendant longtemps, l’objectif thérapeutique a porté principalement sur l’atténuation des symptômes moteurs de la maladie. Les traitements proposés aujourd’hui constituent un progrès mais leur efficacité reste limitée. Par ailleurs, la prise de médicaments visant à pallier un manque de dopamine ou, à un stade avancé de la maladie, l’implantation chirurgicale d’électrodes de stimulation à haute-fréquence (Deep Brain Stimulation) dans le cerveau, ne sont pas anodins : les risques et les effets secondaires associés ne sont pas négligeables.

Le développement du modèle singe MPTP a permis d’ouvrir d’autres perspectives de recherche pour comprendre l’origine de la maladie (lire à ce sujet l’article de l’Inserm sur les travaux d’Erwan Bézard). La priorité désormais est d’empêcher l’aggravation des lésions neurologiques avant qu’elles ne s’étendent de manière irrémédiable pour protéger, voire reconstruire le cerveau lésé. C’est dans ce contexte qu’est apparue, au début des années 80, la thérapie cellulaire. Le principe est simple : greffer des cellules capables de générer de nouveaux neurones dopaminergiques afin de restaurer la zone lésée. De nombreuses études utilisant cette technologie ont ainsi émergé ces quatre dernières décennies. La plupart consistent à greffer des précurseurs de neurones dopaminergiques ou des neurones dopaminergiques matures. Cependant, il reste encore de nombreuses étapes à valider pour que ce traitement soit enfin accessible aux patients.
Les singes ayant reçu la greffe ont récupéré leurs capacités motrices et cognitives et présenté une amélioration de la qualité du rythme veille-sommeil.
En février 2022, une étude lyonnaise impliquant plusieurs équipes travaillant dans des domaines variés des neurosciences a apporté de nouveaux résultats prometteurs sur l’utilisation de la thérapie cellulaire grâce à l’utilisation du modèle singe MPTP.
Dans le cadre de cette étude, des précurseurs neuraux ont été greffés dans plusieurs sites des ganglions de la base (substance noire et striatum). Ces précurseurs neuraux ont la particularité d’avoir un potentiel de différenciation plus important que les précurseurs dopaminergiques. En effet, ils sont capables de donner différents types de neurones (notamment dopaminergiques ou sérotoninergiques), mais également des cellules gliales de type astrocytes. En raison de leur effet neuroprotecteur, ces dernières jouent un rôle important dans la survie des cellules greffées et des cellules endogènes.
Les chercheurs ont montré que les neurones dopaminergiques et sérotoninergiques nouvellement générés seraient capables de former des connections synaptiques avec les neurones de l’hôte, permettant ainsi de rétablir un réseau neuronal fonctionnel. En outre, les singes ayant reçu la greffe ont récupéré leurs capacités motrices et cognitives et présenté une amélioration de la qualité du rythme veille-sommeil. Ces résultats suggèrent que la récupération fonctionnelle est directement liée au taux de survie et au degré d’intégration des cellules greffées.
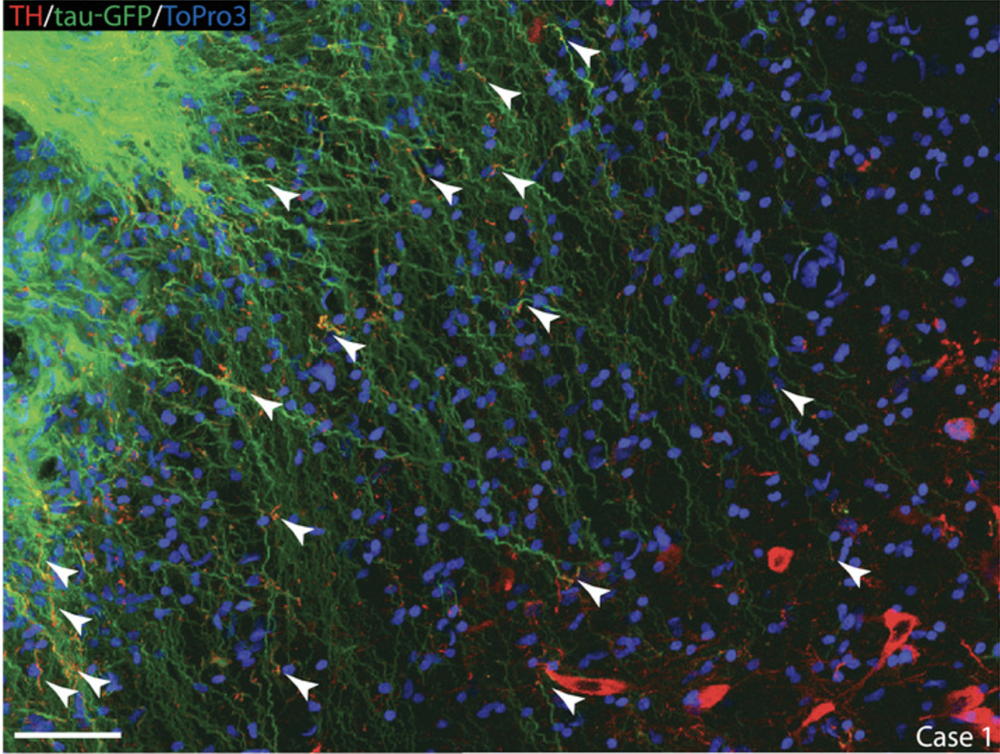
Quelles sont les perspectives thérapeutiques ouvertes par ces résultats ? La thérapie cellulaire est une piste très prometteuse comme traitement pour combattre la maladie de Parkinson. Ce qui explique que de nombreux essais cliniques soient en cours (cf liens ci-dessous). Les effets cognitifs décrits dans cette étude apportent de nouvelles perspectives pour les applications possibles de la thérapie cellulaire.
A propos des essais cliniques en cours
- The promise and potential of stem cells in Parkinson’s disease (Nature).
- Phase 1 Clinical Trial for Advanced Parkinson’s Disease (BlueRocks Therapeutics).
- Les études en cours de thérapie cellulaire appliquée à la maladie de Parkinson (ClinicalTrials.gov).








